什么是一致性评价?
在说一致性评价之前,先简单从研发角度做个分类——原研药和仿制药。原研药是指公司自主研发出来的创新药,注册有专利保护期。而仿制药是等原研药专利到期后,进行仿制生产的药品。
仿制药是否与原研药同样安全有效对于药品本身是非常关键的,一致性评价就是评价仿制药与原研药的一致性程度。一致性评价的全面开展将极大改变国内医药行业市场格局,提高药品质量,提升国内药企的生产研发质量水平线和国际市场竞争力,是利国利民的大事。
具体来说,一致性评价即要从药学等效性(PE)和生物等效性(BE)两个维度去评判仿制生产药物是否与原研药品(即参比制剂)一样具备相同的质量和效果。
药学等效(PE),即指同样的剂型要包含同样量的原料药,细化到处方、质量标准、晶型和杂志等主要药学指标一致,同时药品特征的溶出曲线也作为质量标准进行考核,药学等效在体外进行检验测试即可。
生物等效(BE),即指在人体内仿制药和原研药的吸收速度和吸收效果呈一致性,所以BE作为一致性评价的核心,需要在人体内进行测试,一般称为临床试验。
因药品的特殊性,一致性评价是一件细致且耗时耗钱的事,其中单品种的一致性评价成本约为500万元,标准审批需要32个月。
成本构成:其中药学部分250万元,BE部分250万元,BE部分中医院分得125万元,CRO/生物分析分得125万元。
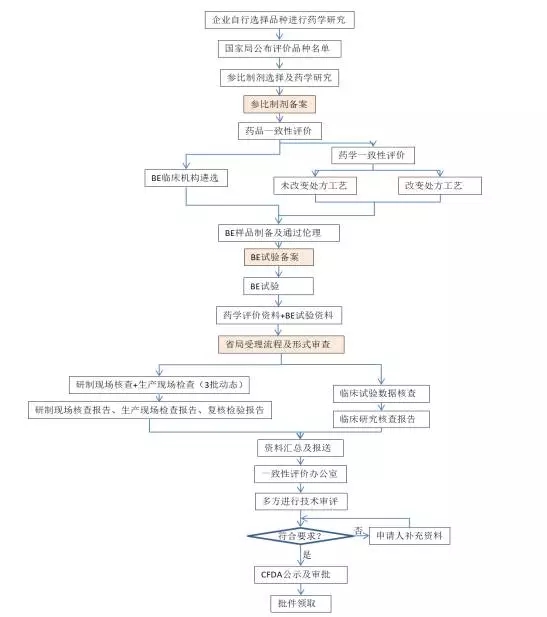
标准审批流程:进入参比制剂备案后需要6-12个月时间才能进入BE备案,进入BE备案后需要6个月时间完成BE试验,完成现场检查后需要6-10个月的时间完成最终审批。这三个重要的时间节点(图中标黄),可以判断申报企业的一致性申报处于哪个阶段。
来看看仿制药一致性评价的具体流程:
为什么说仿制药一致性评价很重要?
2016年3月,国务院正式出台《关于开展仿制药质量和疗效一致性评价的意见》,正式开启国内仿制药一致性评价的序幕。随后,国家食品药品监督管理总局(CFDA)于2016年5月发布了公告,做出执行层面的具体规定:
1.289种基药目录品种需要在2018年底前完成一致性评价;
2.其余品种限定在首家完成的三年内完成;
3.同一品种达到3家以上通过一致性评价的,将不再列入集中选购名单。
对于仿制品种,上市前未按照与原研药品质量和疗效一致性原则进行申报和审评的,需要进行一致性评价。如果是改规格、改剂型、改盐基的仿制品种,按有关规定开展一致性评价。
展开解读一下,基药目录是国家基本药品目录,是医疗机构配备使用药品的依据。既然是基本药品目录,所涵盖的药品是适应基本医疗卫生需求、剂型事宜、价格合理、保障供应的药品。这次针对的是基药目录中289项品种进行一致性评价,对应的是各家医药企业17740个生产批文,需要在2018年底完成。
其他非基药目录289品种的仿制药,首家完成一致性评价后的3年内,没有完成一致性评价的,将不再进行评价及批文的发放。
综合考虑到一致性评价需要的时长和成本,时间窗口很窄,对各大药企业带来了很大的挑战。选择有竞争力又符合自己的研发仿制能力的产品,尽快进行一致性评价成为了各大药企战略的重中之重。
目前的进展情况:
289目录仅剩下一年的窗口期,积极竞争一致性评价的企业已逐步开始准备现场考察等待一致性评价获批。还在等待参比制剂干活的企业实质已是半放弃状态。
大部分企业进入参比制剂备案阶段。截止2017年6月份,289目录的有2890条参比制剂备案记录,包含245个品种,620家企业,平均每个品种有10家以上的企业备案,竞争十分激烈。个别药品参比制剂备案竞争激烈。前10个品种备案数量超过50家企业,阿莫西林、辛伐他汀竞争最为激烈。阿莫西林需要完成一致性评价的生产批文共228个。
仅有少部分企业进入BE备案阶段。截止2017年6月份,BE备案平台共收到公布195条BE备案记录,包含118个品种,122家企业,其中苯磺酸氨氯地平片和阿莫西林胶囊的BE备案数据最多。
进入现场检查阶段的企业稀少,仅有两位数左右。截止2017年6月份,目前完成BE的企业稀少,预计2018年前后才有企业正式通过一致性评价。
按照目前进度,仅约1%的批文推进至第二、第三阶段,预计将超90%的生产批文将遭到企业放弃并被清理。
一致性评价的实施影响?
一致性评价很有可能是很多医药企业的生死线。它带来医药行业的重新洗牌,生产批文将大幅减少,一大批落后产能及不具备竞争力的企业将被淘汰。强者恒强,医药市场的由淘汰落后产能带来的空缺需求,将由优胜者进行填补;同时,政策上对通过一致性评价的药品倾斜,例如医保支付支持、医疗机构集中、优先采购等都将让龙头企业的竞争优势进一步得到加强,医药市场集中度将得到提升。
对于首仿药生产型企业而言,通过一致性评价的药企,在国内药品价格明显占优的情况下,国产药品进行进口替代将是一个大趋势。
而对于普通药品生产型企业而言,具有资本优势和技术优势的企业,一致性评价将淘汰大批落后产能,优势企业将从价格竞争中走向质量竞争,市场集中度将大幅提升。
借鉴日本1998年进行药品再评价的经验,2011年日本药企的数量不足1995年的1/3,药品再评价加剧了药企之间的竞争,很多企业会被淘汰。
我们正在借鉴美日国家的经验,通过一致性评价将药品生产的门槛提高,对药品的质量进行把关,同时从政策导向上对具有研发能力的医药企业进行奖励。对于终端消费者而言,未来在药品上的选择更加放心,同时消费者可以以国产的价格买到与原研药/进口药品疗效一致的药品。
以上就是一致性评价机构--桐晖药业小编分享的有关“仿制药行业一致性评价知多少?”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的CRO公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的药学研发、临床预BE、临床试验等临床评价服务,实现药学到临床一站式服务解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!