医药行业高速发展,国内CRO迎来历史机遇
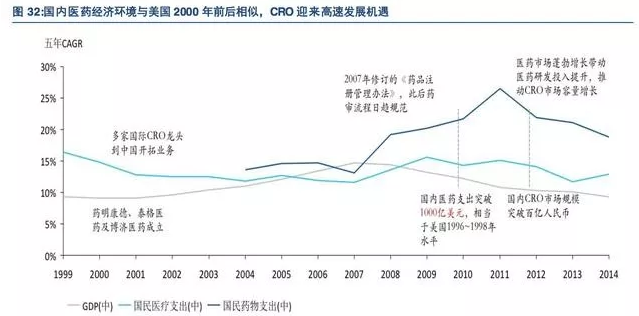
CRO行业的发展离不开医药研发水平的不断提高,医药研发水平与医药行业整体发展水平密切相关。我们认为,从国内视野来看,国内医药市场仍将长期处于高速增长期,研发投入增长空间巨大,为CRO行业的快速发展奠定了坚实基础;从国际视野来看,目前国内医药行业整体发展水平与美国历史水平相似,CRO行业迎来快速发展的历史机遇。
1)国内视野:医药市场高速增长,研发投入空间巨大
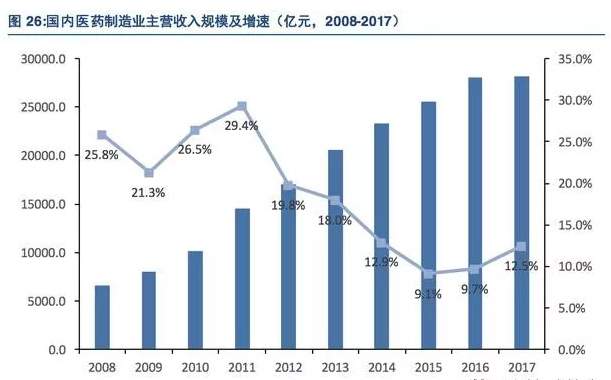
进入二十一世纪以来,受人口老龄化进程加快,政府卫生投入加大,居民对健康重视程度提高等影响,国内医药市场需求强劲,处于高速发展阶段。截至2017年,国内医药制造业主营收入规模达到28186亿元,近5年复合增长率达到10.5%,显著高于全球平均水平。
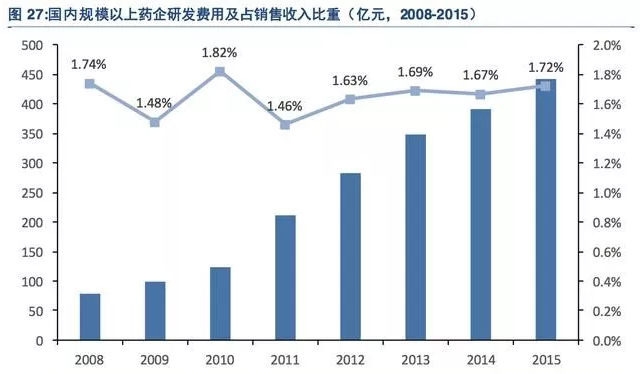
尽管如此,国内医药企业新药创新能力和研发投入还处于较低水平,截至2015年,我国规模以上医药制造企业研发投入仅为445.1亿元,占销售收入比重仅为1.72%,与发达国家研发投入占比13%以上差距明显,未来提升空间巨大。
2)国际视野:对标美国历史情况,快速发展历史机遇
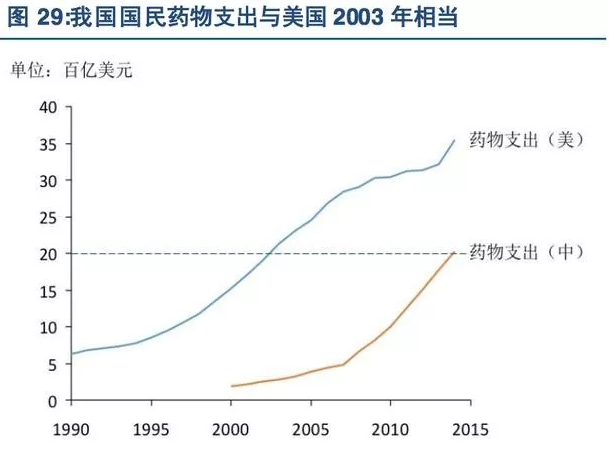
横向对比美国市场,目前国内整体医药行业发展水平仍然差距明显,2015年我国国民药物支出相当于美国2003年水平,药物支出占GDP比重相当于美国1997年水平,也正因如此,国内CRO行业有望与历史时期美国CRO行业发展进程类似,迎来高速发展的历史机遇。
从存量看,国内医药市场大约处于美国1995至2005年这一时期,国内CRO行业有望迎来高速增长的历史机遇。当时正是美国医药市场蓬勃发展的黄金时期,全球CRO龙头公司昆泰、精鼎、Icon等公司逐步实现融资上市,由于药物研发投入大幅增加,大批CRO公司在这一阶段的收入和利润成倍增长,得到迅速扩张。
从增量看,国内医疗支出和药物支出的5年复合增长率远高于美国同一时期,国内医药市场快速扩容将促进药企研发投入不断加大,国内CRO行业有望迎来比美国二十世纪末更辉煌的业绩增长。
医药创新政策利好,推动国内CRO市场扩张
医药行业具有政策导向性高的特点,早期国内医药市场主要产品以仿制药为主,创新药研发动力不足,CRO市场需求度相对较低。
近年来国家层面出台的系列政策将促进国内新药创制的发展,推动医药产业实现由仿制为主向自主创新为主的战略转变。
无论是将医药创新写入国家发展战略,还是出台药审改革等细节配套政策,都将促使国内创新药研发积极度大大提升,有力驱动国内CRO市场快速扩张。
1)国家发展战略,鼓励医药创新
近十年来,国家发展战略层面多项政策均显现出对医药创新发展的鼓励与支持。在“十二五”和“十三五”期间,国家对医药创新的投入逐步增加,将极大地促进国内制药企业对创新药物研发投入,并将加大药品研发过程中对于药品安全性、有效性的检验需求,带动国内CRO市场的持续增长。
2)药审改革等配套政策,促进新药研发
自2015年8月,国务院发布关于改革药品医疗器械审评审批制度的意见首次提到加快创新药的审评审批后,多项配套政策陆续发布。
一方面,创新药纳入优先审评快车道直接缩短了新药上市时间,提高了制药企业新药研发的积极性,另一方面,通过优化临床试验申请管理,推行上市许可持有人制度、改革新的化药注册分类等配套政策,进一步完善了新药研发流程的各个环节,为国内制药企业开展新药研发提供了良好环境。
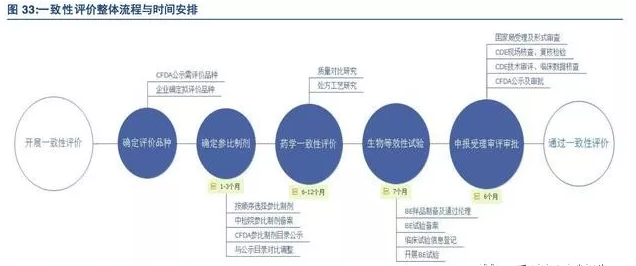
一致性评价进展迅速,BE订单新增百亿市场
我国是仿制药大国,由于过去批准上市的仿制药没有与原研药一致性评价的强制性要求,有些仿制药在疗效上与原研药存在较大差距,因此对已经批准上市的仿制药进行一致性评价是我国仿制药强国的必经之路。
从2012年1月20日,国务院发布《国家药品安全“十二五”规划》首次提出要全面提高仿制药质量,对仿制药分期分批进行质量一致性评价开始,多项配套政策不断落地,一致性评价进展迅速,截至目前已有两批(17个品种,22个受理号)仿制药通过一致性评价。
BE试验是整个一致性评价流程的重要环节,CRO行业(尤其是临床CRO)迎来机遇。根据CFDA上市药品数据库批文数量统计,需要进行一致性评价的仿制药约涉及11.6万个批文;
2018年底前完成一致性评价的化学药品仿制药口服固体制在基药目录中有289个品种,17740个批准文号或注册证号,涉及1817家国内生产企业、42家进口药品企业。
仿制药一致性评价工作从参比制剂备案到最终通过预计需要20~28个月。
对于药企来说,一致性评价是一场时间紧,任务重的淘汰赛,与CRO公司合作成为其快速高效完成一致性评价的重要手段。
全球市场战略转移,国内CRO市场提供增量
由于CRO行业在全球各地的兴起与发展时间大不相同,全球各地区的CRO市场份额与增速差异较大,从细分地区来看,新兴地区CRO市场扩容趋势明显。
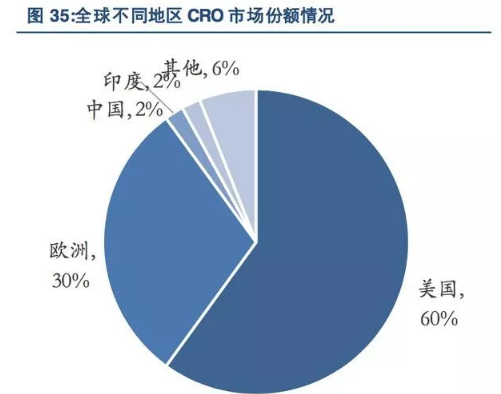
从存量来看,欧美地区占据了全球CRO市场90%左右的市场份额,处于主导地位,而印度、中国等亚太地区仅占据了全球CRO市场的较小份额。
从增量来看,目前新兴地区CRO市场增速明显,尤其是中国等亚太地区处于高速增长阶段。
从2011年到2016年,美国、西欧CRO市场增速相对缓慢,分别为9.60%和9.40%,而东欧、印度、中国等亚太地区、拉丁美洲等其他地区的CRO市场增速分别达到11.40%、14.85%、20.00%、15.60%和9.80%。
欧美地区CRO市场增速放缓趋于饱和,以中国为代表的新兴地区市场将会快速扩容,后续全球CRO市场有望逐步实现向新兴地区的转移,进一步促进中国等地CRO行业的发展。
基于:
1)国际多中心试验的开展以及全球CRO巨头在全球范围内业务不断扩张,需要新兴市场提供增量;
2)国内具有庞大的患者群体,临床试验样本充足,对于全球药企来说,能够短时间内完成大量病例入组,完成药物安全性、有效性评价,加快整个新药研发进程;
3)国内具有人力物力方面成本优势,在临床前研究及临床研究各阶段研发费用仅为发达国家的30-60%;
4)国内自身正在经历医药产业的迅速崛起,研发支出增长迅速,内生需求促进CRO市场快速增长,同时国内药审改革有望缩短药品审批流程,提高新药研发积极性,促进国内CRO市场发展壮大。
全球CRO行业集中度较高
龙头公司领先优势明显
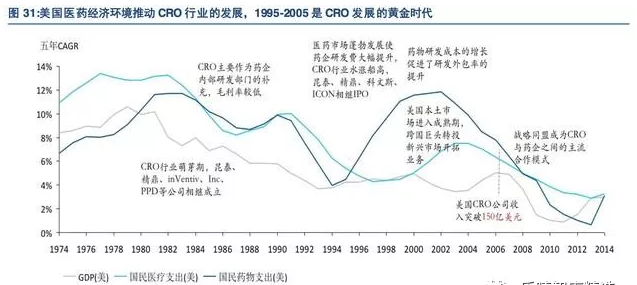
CRO行业兴起于20世纪70年代,经过近四十年的发展,全球CRO行业趋于成熟稳定,具有较大的市场规模,形成了一套完整的业务流程体系。
据BusinessInsights统计,截至2015年底,全球CRO公司数量已超过1100家,承担了全球大部分新药研发任务。
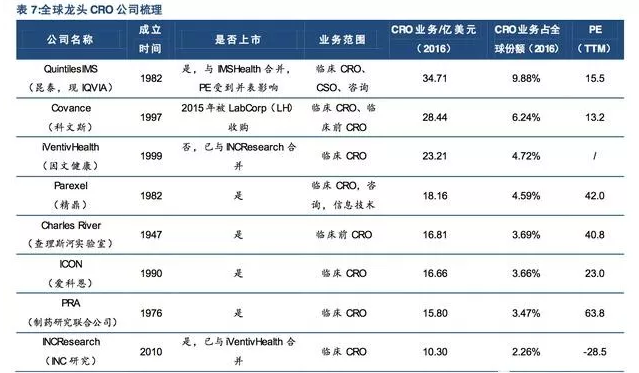
目前全球范围内的CRO行业龙头主要包括QuintilesIMS、Covance、Parexel、inVentivhealth、ICON、PRA、CharlesRiver等大型跨国CRO公司。
新药研发过程的复杂化与不同CRO公司发展路径的差异化,导致全球CRO公司业务体量两极分化极为严重,具有极高的行业集中度,截至2016年底,全球Top10CRO公司垄断了40%以上的市场。
对于大型CRO公司来说,需要具有足够的专业设备、丰富的人才储备、较强的科研能力和能够多线程管理试验的IT系统,对公司资金要求极高,造成了极高的专业壁垒。
对于小型CRO公司来说,进入壁垒较低,在全球范围内占据绝大多数比例,CRO行业龙头的对市场的频繁并购整合进一步挤压了小型CRO公司的生存空间。
全球CRO公司按照具体业务划分,主要包括临床前CRO公司(主要负责药学研究和临床前研究)与临床CRO公司(主要负责I-IV期临床研究)。
对于临床前CRO公司,由于业务分工高度精细化,龙头公司专注特定领域,技术优势明显,具有极高的话语权。该领域龙头CharlesRiver拥有超过150种生物模型,是世界上最大的实验动物模型公司;Covance在药物毒理学和化学检测上具有领先优势;药明康德在化学合成方面优势明显;PPD在非临床药理学/毒理学试验及I期临床试验业务优势明显;
对于临床CRO公司,由于业务同质性较高,龙头公司在客户资源积累和服务质量方面具有核心竞争力,“强者恒强”成为临床CRO公司的发展法则。该领域龙头QuintilesIMS拥有强大的客户资源,与世界排名前20的生物医药公司都有合作关系。

国内CRO行业集中度低,行业洗牌有望强者恒强
1) 起步较晚,行业集中度低
国内CRO行业刚刚发展20年左右,与全球CRO行业发展相比仍处于起步阶段。1996年,MDSPharmaService投资设立了中国第一家真正意义上的CRO,从事药物的临床研究业务,随后Quintiles、Covance及Kendles等跨国CRO公司开始陆续在中国设立分支机构。
由于国内医药产业的高速发展,跨国制药企业陆续开始在中国启动研发业务,同时,药明康德、睿智化学等专注于早期化学研究、昭衍新药等专注于临床前研究服务、泰格医药等专注于临床试验研究服务的民营企业的高速发展,都推动了国内CRO行业的成长。
据HSMAP不完全统计,目前国内处于存续状态的涉足医药外包服务企业有525家左右,其中临床服务企业248家,非临床服务企业262家,综合性服务企业15家,临床研究服务与非临床研究服务企业数量基本相当。
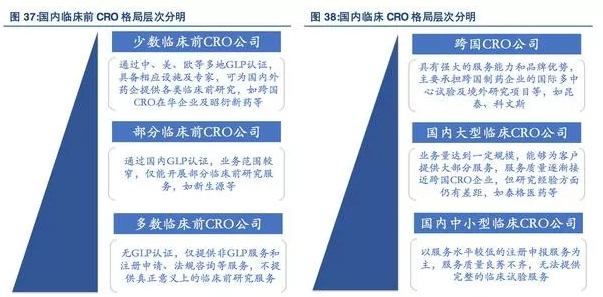
虽然国内逐步涌现出一些大型本土CRO公司,但与国际龙头CRO公司相比在业务规模、管理经验和核心竞争力方面仍有差距。整体来看,目前我国内CRO行业集中度相对较低,竞争格局主要分为三个层次:
首先,是以QuintilesIMS、LabCorp(Covance)、PPD为代表的大型跨国CRO公司以及药明康德等大型CRO公司,得益于强大的资金实力、庞大的业务规模、丰富的项目经验,占据着国内CRO行业的顶尖位置。这些CRO公司承担了大量跨国药企在我国的新药研发工作,但其在国内药企外包服务市场份额较低。
其次,是以泰格医药等为代表的的本土中大型CRO公司,已经逐渐从行业竞争中脱颖而出,在技术实力和服务质量等方面,逐步向大型跨国CRO公司靠拢。
最后,是行业内存在着的大量小型CRO公司,其主要业务以提供技术难度较低的注册申报为主,绝大多数尚未建立起充足的技术人员团队,无法提供系统的临床前CRO服务于临床CRO服务。
细分业务来看,临床前CRO行业中,根据有无国内GLP及国外GLP资质可以分为三个等级,并且其主要提供的服务也有较大不同,临床CRO行业中,主要业务由难到易包括国际多中心试验、进口注册临床试验和国内制药企业注册临床试验三类,对临床CRO公司的规模资源、资质水平要求也有不同要求。
2)监管趋严,行业洗牌有望强者恒强
2015年7月,CFDA下发了“史上最严药物临床试验数据自查令”(117号文件),对1622个已申报生产或进口的待审药品注册申请开展药物临床试验数据核查,核查对象是新申请上市的药品;
同年11月,CFDA发布《药物临床试验数据现场核查要点》,要求临床试验和生物等效性试验的研究数据、检测数据、试验过程数据、伦理等全部真实完整;
2016年3月,CFDA发布《药物临床试验数据核查工作程序(暂行)》,进一步明确了临床数据核查的工作程序。
117号文件下发后,大量药企主动撤回药品申请,从2015年7月前后CDE承办药品申请数量来看,提交药品申请的数量明显下降。“7·22事件”之后,国家层面持续加强药物临床试验数据自查核查,药审监管的力度不断加大。
我们认为,随着临床试验质量要求的不断提升,部分落后CRO产能将会逐渐被淘,CRO行业的整体集中度将进一步提高。
短期来看,排名靠前的CRO公司都有一定的撤回项目,使公司品牌和业绩受到一定影响,过审的药品数量也将会减少。
当时核查累计涉及126家CRO公司承接的605个项目,其中核查项目超过20个的CRO公司有6家,分别是广州博济(70)、沈阳亿灵(46)、安徽万邦(41)、上海凯锐斯(28)、北京万全阳光(27)和杭州泰格医药(22),占核查总数的40%。
长期来看,新药上市过程中的BE试验、临床试验和注册申报等专业度要求的不断提高,将有力推动药企与CRO公司的密切合作,特别是利好实力较强的龙头公司。
由于国内CRO市场高速增长,国内CRO公司在监管趋严的同时,也将会面临跨国CRO公司的激烈竞争压力,我们认为,对于部分优质的本土企业来说,凭借其长期积累的国内医疗资源、中国专业团队以及较低的人力成本等优势,有望在爆发增长的国内CRO市场中分享巨额收益,行业洗牌的背景下实现强者恒强。
他山之石:成熟市场全球CRO巨头的发展路径
加速推进企业并购整合,打造全球业务一体化
随着全球CRO行业整体水平不断提高,行业竞争日益加剧,近十年来,全球龙头CRO公司在全球范围内展开的企业并购整合层出不穷,整体业务布局趋于完善,确立市场领先地位。
如QuintilesIMS并购AdvionBioServices、OutcomeSciences、Novella等系列公司,与Quest合资拓展新兴肿瘤、医疗器械、诊断领域客户群,增强生物分析试验能力,与IMS合并打造数据资讯和临床研究的一体化服务领头羊;
PPD通过并购依格斯、保诺科技扩大中国市场影响力;Parexel通过并购ClinPhone、AtlasMedicalServices拓展临床技术,增强研发和临床试验能力等。
透视全球CRO巨头的发展路径,不难发现,CRO公司能够通过对各个细分领域优质公司的并购整合,优化自身业务结构,逐步实现业务纵向一体化,提高客户企业合作意愿度;
同时通过全球范围的布局在CRO市场迅速增长的新兴地区持续增加市场份额,扩大公司的市场规模,帮助CRO公司实现快速成长,形成并巩固业内的龙头优势地位。
一纸订单升级风险共担,盈利能力提升明显
CRO公司与制药企业之间的合作模式主要分为传统模式、创新模式、结果导向模式和风险共担模式4种。
在全球范围内,随着CRO公司业务布局与渠道资源不断成熟,其在医药研发工作中的重要性逐步提升,基于增强合作粘性,降低研发风险,提高整体收益的角度,CRO公司和制药企业不断促进合作模式升级,目前全球龙头CRO公司基本脱离了传统合作模式,逐步向风险共担、利益共享的合作模式靠拢。
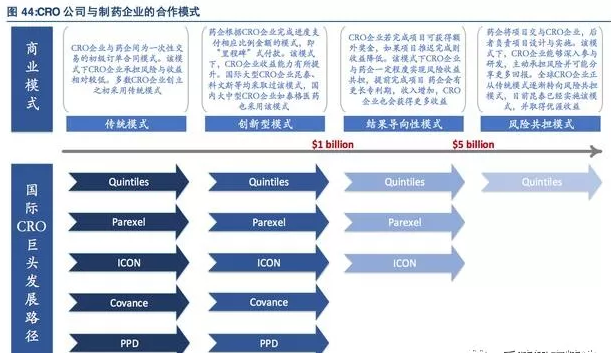
CRO公司通过风险共担的商业模式能够深入参与新药研发,充分发挥自身专业团队、技术平台的资金渠道等方面的优势,为制药企业提供全面高效的服务,加强与制药企业的合作粘性,共同承担研发风险的同时有望获得新药上市后的巨额回报,未来建立风险共担收益共享的战略合作模式、将会是全球CRO公司商业模式发展的主线。
可以攻玉:差异化背景下国内CRO的发展路径
相对于全球CRO行业发展水平,国内CRO行业仍处于萌芽阶段,无论是行业发展水平还是企业发展水平都与全球CRO行业及CRO巨头差距明显。目前国内CRO市场本土前10大CRO公司的国内CRO市场份额不足20%,与全球前10大CRO龙头公司的全球CRO市场份额超过50%相比,差距仍十分明显。
基于国内CRO行业与全球CRO行业的差异化背景,从长期和短期两方面去判断国内CRO行业的发展趋势更为合适。
短期来看,国内CRO市场即将进入高速发展阶段,国内CRO公司适合快速增强现有业务的核心竞争力,不断积累品牌口碑,在爆发增长的国内CRO市场中快速分享巨额收益;
长期来看,借鉴全球CRO巨头的发展路径,加速国内外企业的收购并购,实现纵向业务一体化,横向业务国际化,是未来国内CRO公司向全球CRO巨头发起冲击的必经之路。
基于前文分析的国内外CRO行业大背景,目前由于全球医药产业的不断增长,新药研发投入的不断增加与研发与外包渗透率的增加,CRO行业在全球范围内具有较高的景气度;而国内CRO市场在内生需求释放、医药创新政策催化、一致性评价工作推进和全球CRO市场转移的背景下将会迎来爆发增长。(来源:东兴证券
作者:张金洋)
以上就是广州CRO外包服务公司-桐晖药业小编分享的有关“临床试验”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的CRO公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的药学研发、临床预BE、临床试验等临床评价服务,实现药学到临床一站式服务解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!