口服固体制剂一致性评价工作陆续报出成果,化学药品注射剂一致性评价也被提上日程。
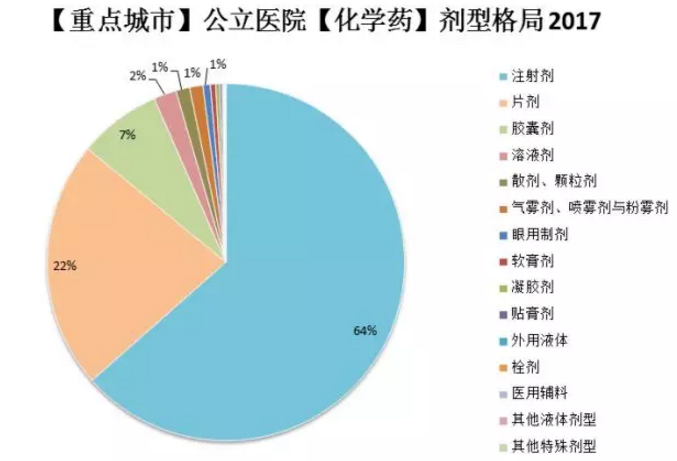
相较于口服固体制剂,注射剂市场份额更大,覆盖范围更广,涉及企业也更多。仅统计重点城市公立医院数据,2017年注射剂型份额占64%,片剂、胶囊剂等口服固体制剂统共约占30%。
2017年12月22日,药品审评中心发布《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》。(以下简称“征求意见稿”)
征求意见稿没有规定开展一致性评价的注射剂范围,只提到“除氯化钠注射液、葡萄糖注射液、葡萄糖氯化钠注射液、注射用水等原则上不纳入一致性评价范围”,这意味着几乎所有化学仿制药注射剂都要开展一致性评价工作,国内注射剂产业将迎来一轮剧烈的去产能。
有了口服固体制剂一致性评价的经验,按说注射剂一致性评工作应该会更加顺利。但两者有着不同的着重点,口服固体制剂一致性评价旨在提高药品质量、有效性;而注射剂特别是静脉注射剂,属于高风险剂型,开展一致性评价重点则放在安全性问题上。
故注射剂一致性评价工作将面临不同的技术障碍和难点。
难题一:参比制剂
口服固体制剂的一致性评价中,参比制剂的选购一度成为困扰企业的大障碍,随着官网参比目录的公布,才得以解决。
注射剂的参比制剂选择,按照“征求意见稿”的选择顺序与口服固体制剂一致:首选国内上市的原研药,原研未在国内上市,则选欧美日上市的原研药;原研停产,可选美国橙皮书RS标识的药品。
万一遇到处方不一致或上述参比制剂均缺乏的难题,如何解决?
支招:
首先,判断立题的科学性。从药物理化、生物学性质、临床治疗需要、临床风险与疗效等方面评估该注射剂的必要性和合理性;
其次,判断处方工艺的合理性。对产品的处方组成、生产工艺及逆行分析,评估是否需要对处方、工艺、包材进行变更以便提高产品质量;
第三,开展非临床安全性评估。研究内容包括毒理研究、特殊安全性试验等,全面评估注射剂的安全性。
最后,开展临床安全性和有效性试验。对于无原研或国内新药的注射剂,需查证其是否有完整的临床研究,再根据情况开展临床研究以获得充分的安全性、有效性信息,评估临床应用的风险/利益比。
难题二:原辅料
口服固体制剂的辅料可以不同,但如果注射剂是溶液型的,就要求仿制药的原辅料与原研的原辅料相同。根据“征求意见稿”,辅料的用量相同是指仿制药辅料用量为参比制剂相应辅料用量的95%-105%。
这就意味着药对原研的解析必须更加彻底完整。
原料药的质量是关键,企业可通过制定采购标准严格把关来控制原料药的质量。
原辅料与制剂关联审评,制剂企业作为药品质量管理的责任主体,须对原辅料供应商加强审计,与之建立授权使用和监督的质量保障制度。
对于特殊辅料国内无来源,如何解决?
支招:
积极与原研的辅料厂家合作,是解决特殊辅料来源的有效途径。如不能获取,可寻求国外已有DMF的厂家引入,与国内辅料厂家合作订制或自主研发,以提升辅料质量与制剂关联申报。对用于注射途径的新辅料,应有安全性应用试验或文献支持,若无,则建议对辅料进行相关的毒理研究,以获取辅料本身的安全性信息。
难题三:包材
“征求意见稿”指出:注射剂使用的直接接触药品的包装材料和容器应符合总局颁布的包材标准。不建议使用低硼硅玻璃和钠钙玻璃。
目前国内多数注射剂包材使用的是低硼硅玻璃和钠钙玻璃,如果按照上述条款实施,大多数企业都需更改包材。
包装材料及容器对注射剂的安全使用有着巨大影响,正大天晴的天晴甘美上市初期使用低硼硅玻璃瓶就容易导致药品出现脱片、白点等可见异物,故全部换成中硼硅玻璃瓶,仅此一项每年成本将多出3000万元。
如果包材相容性研究证明低硼硅玻璃和钠钙玻璃符合要求,是否可以放宽使用范围,这个需看正式文件的规定了。
难题四:三改品种
改规格、改剂型、改盐基(简称“三改”),按“征求意见稿”,需结合原研药品规格的上市情况,充分论证“改规格、改盐基”的科学性、合理性和必要性,同时“改剂型和改盐基”还得证明其有明显的临床优势。
如何证明其临床优势呢?
支招:
三改的注射剂,应评价与原研的异同和优劣,产品质量应做到一致。
改剂型注射剂:对于大容量注射剂、小容量注射剂、注射用无菌粉针之间互改,要考虑各种剂型的无菌包证水平、杂质控制水平、工艺可行性、临床使用是否方便等,以便评估其优势。对于口服改注射,应从临床治疗需要并结合注射剂特点来判断其合理性,并根据情况补充相应的临床研究。
改盐基注射剂:应分析改盐基后是否会增加潜在安全风险,成盐方式带来的理化性质改变是否影响生产工艺、剂型、规格的选择等。一般情况下,改盐基较难体现临床优势。
改规格注射剂:应在其使用说明书规定的用量范围内,一般不得小于单次最小给药剂量,也不得大于单次最大给药剂量。对新增规格特别是给药浓度发生变化的情况,应有数据说明改规格后产品临床使用的安全性和有效性。
尽管注射剂一致性评价有各种难题和阻碍,而且配套的细节还未正式发布,但注射剂一致性评价的推进速度快于业内预期。
自今年4月份开始,注射剂一致性评价的申请陆续被CDE受理,审评进度明显加快。5月份共有20条注射剂一致性评价申请,涉及8个重磅注射剂品种。
截止目前,至少已有8个注射剂通过/视为通过一致性评价。(见:8个注射剂率先通过一致性评价,都用什么招数?)
注射剂一致性评价将是注射剂企业一个优胜劣汰的过程,路上充满着荆棘挑战,质量不能达标的注射剂、没有技术和资金实力做一致性评价的企业将面临退市。同时一致性评价工作也给行业提升质量赋予机遇,优质的企业把一致性评价看作提升产品、发挥优势的难得契机。(来源:汇聚南药)
以上就是一致性评价公司-桐晖药业小编分享的有关“注射剂一致性评价中的四大难题!”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的仿制药一致性评价公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的药学研发、临床预BE、临床试验等临床评价服务,实现药学到临床一站式服务解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!