3月21日,CDE官网显示,阿斯利康/第一三共靶向HER2抗体药物偶联物(ADC) Enhertu (trastuzumab deruxtecan)在国内申报上市,适应症未知。
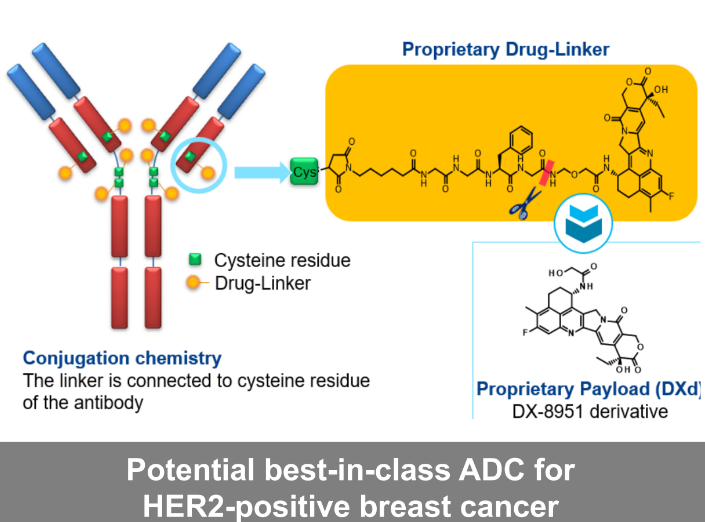
Enhertu是一款靶向HER2的ADC,采用第一三共专有的DXd ADC技术设计。由HER2单抗通过稳定的四肽可裂解连接子连接于拓扑异构酶I抑制剂有效载荷(依沙替康衍生物)上。该产品是第一三共肿瘤产品组合中领先ADC,也是阿斯利康ADC科学平台中最先进的项目。
美国FDA批准上市,用于治疗既往已经接受2种及以上HER2靶向疗法的成人不可手术切除或转移性HER2阳性乳腺癌患者。
2021年1月15日第2项适应症获FDA批准,用于既往接受过基于曲妥珠单抗治疗的局部晚期或转移性HER2阳性胃或胃食管交界处腺癌患者。今年1月17日,FDA还受理了Enhertu 治疗既往接受过抗HER2治疗方案的不可切除或转移性HER2阳性乳腺癌成人患者的补充生物制品许可申请(sBLA),并授予该项申请优先审评资格。在中国,Trastuzumab deruxtecan曾获CDE突破性疗法资格,单药用于既往接受过一种或一种以上治疗方案的HER2阳性局部晚期或转移性胃或食管胃结合部(GEJ)腺癌成人患者的治疗。