仿制化药注射剂是否要做临床试验?是否要做生物等效性试验?可能很多人觉得这是一个很傻的问题。可是,就是这样很显然的问题,其实我们大部分人并不是那么的清楚。
一方面,我们的感觉告诉我们,注射剂吸收应该是完全的,比较仿制药和参比的药代动力学有什么意义?仿制药又为什么要做安全有效性的临床试验?
另一方面,一些新闻会告诉我们,某某仿制化药注射剂产品获批生物等效性/临床啦,所以我们觉得应该有这样的情况吧,但就是不知道这样的审评结论的依据在哪。
首先,从正面的思路去看,仿制化药注射剂,应该做哪些研究?
回答这个问题的文件有:《药物注射剂研发技术指导意见(征求意见稿)》、《化学药品注射剂基本技术要求(试行)》、《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》。后面两个文件均提到了仿制化药注射剂的临床试验要求。
首先,《化学药品注射剂基本技术要求(试行)》说了:“①与上市产品适应症、用法用量一致,且上市产品的安全有效性已经得到了充分的验证和认可;②含有与上市产品相同的活性成份(主药量相同),临床给药浓度一致;③处方合理,辅料不会带来安全性的隐患,制剂因素也不会影响药物的体内行为;④对影响产品的安全性因素(例如杂质的种类与数量)进行了充分评估,不存在安全性的隐患。只需通过药学控制即可达到与上市产品具有相同的安全有效性,一般可以免临床研究。如以上任何一个条件不能确定符合相应要求,应视具体情况进行必要的临床试验。”
如果自研产品符合仿制药定义,产品符合一致性评价要求,仿制的对象符合参比制剂要求,符合原研药的定义,那么上面都说的①②③④一般都可以满足,即不需要进行临床试验。
然后,《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》又说了:“应采用商业批量的样品进行BE试验和/或临床试验。对于FDA或EMA已公布指导原则的特定注射剂品种,建议参照FDA或EMA技术要求开展与参比制剂的对比研究”
你肯定会问,FDA或EMA已公布指导原则的特定注射剂品种指什么?
我们可以在FDA 的Product-Specific Guidances for Generic Drug 中寻找注射剂品种,为了和《化学药品注射剂基本技术要求(试行)》规定的特殊注射剂(脂质体、微球、微乳)区分开,我们避免汇总这些剂型。顺便补充一句,脂质体、微球、微乳有相当一部分在指南中建议做生物等效性试验。然后,可以很容易发现,真的有不少特定品种,推荐进行体外试验、人体临床试验,或者生物等效性试验。
举一些例子:
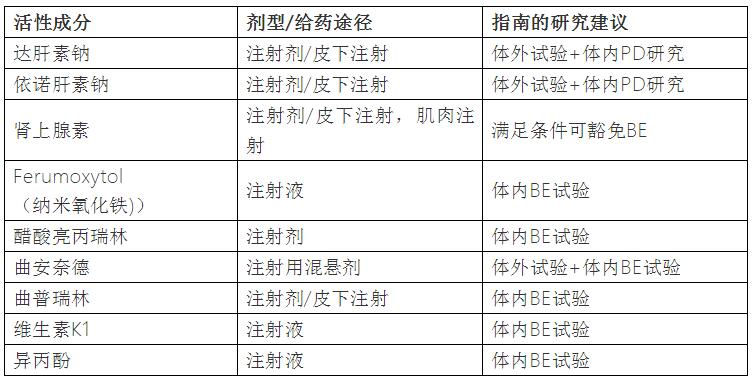
小结:有一些仿制的化学药品注射剂的确是要做大临床或者BE试验的,不仅是脂质体、微乳、微球,也有一些普通注射剂型。具体是哪些品种:FDA或EMA已公布指导原则的特定注射剂品种,建议参照FDA或EMA技术要求开展与参比制剂的对比研究;其他品种,若是不符合《化学药品注射剂基本技术要求(试行)》说的4个条件则需要开展临床试验:①与上市产品适应症、用法用量一致,且上市产品的安全有效性已经得到了充分的验证和认可;②含有与上市产品相同的活性成份(主药量相同),临床给药浓度一致;③处方合理,辅料不会带来安全性的隐患,制剂因素也不会影响药物的体内行为;④对影响产品的安全性因素(例如杂质的种类与数量)进行了充分评估,不存在安全性的隐患;符合4个条件、且不是FDA或EMA要求开展临床试验/BE试验的品种,若怀疑需要开展临床,建议立项时咨询审评中心。
以上就是临床试验机构-桐晖药业小编分享的有关“仿制化药注射剂是否要做生物等效性试验?”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的GSP公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的从药学研发、临床预BE到临床BE的药厂研发一站式解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!